|
|
|
|
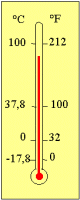
Celsius ve fahrenheit dereceleri arasında; °C
= bağıntıları bulunmaktadır. |
|
Maddelerin fiziksel özellikleri sıcaklıkla değiştiğinden (örneğin, ısınan madde genleşir,
ısınan tel uzar, ısınan iletkenin direnci değişir, ısınan metal renk değiştirir), tekrarlanabilir ve
doğru ölçülebilmesi koşuluyla, bu özelliklerden yararlanılarak termometreler
yapılabilir. Celsius skalasında buzun erime sıcaklığı sıfır
kabul edilmiştir. Ancak, bu değerin çok altında da sıcaklıklar bulunmaktadır.
Daha düşük sıcaklığın mümkün olmadığı en düşük sıcaklık derecesi -273,15°C dir ve bu sıcaklığa,
"mutlak sıfır sıcaklık derecesi"denmektedir. Kelvin skalası işte bu en
düşük sıcaklık derecesini başlangıç olarak kullanmaktadır. Kelvin (K, ' ° ' sembolü kullanılmaz), mutlak sıcaklık denilen termodinamik sıcaklığın birimidir. Kelvin
skalasındaki sıcaklık birim aralıkları, celsius skalasındakinin aynıdır (1 K = 1 °C). Ancak, sıcaklık göstergelerinin
başlangıçları farklıdır. Kelvin ölçeğinin sıfır başlangıç noktası, celsius
ölçeğinin - 273,15 °C değerine rastlamaktadır. Buna göre; kelvin
olarak sıcaklık = celsius olarak sıcaklık + 273 [T (K) = t°C + 273,15] Isı Nedir? Termodinamiğin en önemli kavramlarından biri de
ısıdır. Isı, belirli sıcaklıktaki bir sistemin sınırlarından, daha düşük
sıcaklıktaki bir sisteme, sıcaklık farkı nedeniyle transfer edilen enerjidir.
Isı da iş gibi bir enerji transfer biçimidir. Isı ve iş hiçbir cisimde depo
edilemez, ancak sistem sınırlarında ve geçiş halinde iken belirlenebilir. Her
ikisi de birer eğri fonksiyonudurlar. Bir başka deyişle, ısı ve iş geçiş
halindeki enerjilerdir. Isı birimi iş birimi ile aynıdır, yani joule (J) dür. Eski bir alışkanlık
olarak calorie (cal) de kullanılmaktadır. 1 calorie, 1gram suyun sıcaklığını 14,5°C 'den
15,5°C 'ye yükseltmek için gerekli olan ısı miktarıdır. 1 calorie = 4,187 joule dür. Bir maddenin sıcaklığını değiştirmek için gerekli
ısı; kütlesine, cinsine ve sıcaklık farkına bağımlıdır. Daha büyük kütleyi
ısıtmak için, daha fazla ısı gereklidir. Örneğin, aynı ortam koşullarında, 2
kg suyu kaynama sıcaklığına kadar ısıtmak için gerekli olan ısı, 1 kg suyu
kaynama sıcaklığına kadar ısıtmak için gerekli olan ısının iki katıdır. Farklı maddelerin sıcaklığını aynı miktarda
artırmak için, farklı miktarlarda ısı gerekmektedir. Örneğin, basınç,
sıcaklık ve kütleleri eşit olan hava ve hidrojeni, aynı değerdeki daha yüksek
bir sıcaklığa ısıtmak için, hidrojenin gerektirdiği ısı miktarı, havanın
gerektirdiği ısının yaklaşık 14 katıdır. Bir
maddenin özgül ısısı, o maddenin 1 kg lık kütlesinin sıcaklığını 1 K
artırmak için gerekli ısıdır. Gazların ısıtılması söz konusu olduğunda,
iki farklı durum bulunmaktadır. Bunlar:
Sabit hacimde ısıtma sırasında gazın sıcaklığı ve
basıncı artmaktadır. Örneğin, teorik otto çevriminde silindirdeki gazlara
ısının verilmesi sabit hacimde olmaktadır.
Sabit hacimde ısıtmanın özgül ısısı CV
sembolü ile gösterilir ve ideal kuru havanın CV değeri, yaklaşık
olarak 0,717 kJ/kgK dir. Sabit basınçta ısıtma sırasında gazın sıcaklığı ve
hacmi artmakta, gazın genişlemesiyle iş yapılmaktadır. Örneğin, teorik diesel
çevriminde silindirdeki gazlara ısının verilmesi ve ön genişleme sabit
basınçta olmaktadır. Sabit basınçta ısıtmanın özgül ısısı CP
sembolü ile gösterilir ve ideal kuru havanın CP değeri, yaklaşık
olarak 1,004 kJ/kgK dir. Herhangi bir maddenin sıcaklığını daha fazla
artırmak için, doğal olarak, daha fazla ısıtmak gerekir. Örneğin, 20°C
sıcaklıktaki suyu 60°C sıcaklığa kadar ısıtmak için gerekli olan ısı, 40°C
sıcaklığa kadar ısıtmak için gerekli olan ısının iki katıdır. Sabit basınçtaki ısıtma sırasında ve faz değişim
bölgesi dışında bir sisteme verilen veya sistemden alınan ısı; 1Q2 = mCPm DT dir. Burada; m : kütlesel debi, kg/s, CPm : sabit basınçtaki ortalama özgül ısı,
kJ/kgK, DT: sıcaklık farkı, K, dir. Cisimlerin, herhangi bir etki sonucunda açığa
çıkardığı ısıların ölçülmesinde kullanılan ölçme aygıtlarına, kalorimetre veya
ısı ölçer denmektedir. Isı ölçümünde
karşılaşılan temel güçlük, sistemle çevre arasında oluşan parazit ısı alış
verişleridir. Bu alış verişler, yansıtıcı çeperler ve yalıtkan destekler
kullanılarak sınırlandırılır. Mümkünse, vakumda çalışılır ve dış kap sistemle
aynı sıcaklıkta tutulur. Temel ısı ölçüm yöntemleri üç grupta değerlendirilebilir: · Sıcaklık değişimleri yöntemi Bu yöntemde ısı veren veya alan numune madde, bir
ısı ölçüm maddesiyle çevrilir. Bu madde genellikle kütlesi m, özgül ısısı CP
ve başlangıç sıcaklığı t1 olan sudur. Isı alış verişi sonunda
suyun sıcaklığı t2 ye değişir. Suyun t2 sıcaklığı t1
den büyükse, numune ısı vermiş, t2 sıcaklığı t1 den
küçükse, numune ısı almış demektir. Verilen veya alınan ısı, yukarıda verilen
ısı eşitliği yardımıyla hesaplanabilir. · Faz değişimleri yöntemi Bu yöntemde, ısı ölçüm maddesinin sıcaklık değişimi
yerine, kütlesi bilinen bir saf maddenin sabit sıcaklıktaki faz değişiminden
yararlanılır (örneğin, buzun erimesi, suyun buharlaşması). Isı miktarı, faz
değişimine uğrayan kütle miktarı ile orantılıdır. · Elektriksel ısı ölçüm yöntemi Isı miktarı belirli bir değişime sebep olur. Aynı
değişim sadece elektrik enerjisi harcanarak gerçekleştirilir ve bu enerji
belirlenecek olursa, ısı miktarı belirlenmiş olur. Buradaki elektrik
enerjisi, genellikle bir rezistanstan akım geçirilerek elde edilir ve devreye
paralel bağlanan bir voltmetre ve seri bağlanan bir ampermetre ile ölçülür. Sıcaklık kavramının
ardından, ısının (ısı enerjisinin) bir cisimden diğerine nasıl geçtiği
açıklanabilir. Isı iletim mekanizmaları aşağıda açıklanmıştır: Isı enerjisi,
birbiriyle temas halindeki iki cismin birinden diğerine moleküllerinin
hareketlerine veya bazılarının moleküler çarpışmalarına bağlı olarak
iletilebilir. Bu ısı iletim mekanizmasına "kondüksiyon" denir. İkinci mekanizma, ateşe yakın olan suyun ısınıp yükselerek soğuk su ile karışması
örneğinde olduğu gibi, sıvı veya gaz içerisindeki ısınmış moleküllerin soğuk
bölgelere hareketi yoluyla gerçekleşen ısı iletimidir ve "konveksiyon" olarak adlandırılır. Üçüncü mekanizma ise, güneşin dünyamızı ısıtması örneğinde olduğu gibi, ışınım
yoluyla gerçekleşen ısı iletimidir ve "radyasyon" olarak
adlandırılır. |
|